以下文章來源于Nature Portfolio ,作者Nature Portfolio。

撰文 | Elie Dolgin
1987年底,Robert Malone做了一個載入史冊的實驗。他用信使RNA(messenger RNA,mRNA)鏈和脂滴做了一道 “分子亂燉”,這道基因亂燉里的人體細胞吸收了mRNA,并開始用其合成蛋白 [1]。
Malone當時是美國加州索爾克生物研究所的研究生,他知道眼前的這一切會對醫學產生深遠影響,于是做了些筆記,并簽上了名字和日期。他在1988年1月11日的筆記上寫道,如果細胞能用被遞送到其內部的mRNA合成蛋白,“RNA就能成為一種藥物”。索爾克實驗室的另一名成員也在筆記上簽了名,以備后用。那年的年末,Malone用實驗證明了青蛙胚胎也能吸收這些mRNA [2]。這是第一次有人用脂滴幫助mRNA順利進入一種活生物。
在這些實驗的基礎上,誕生了歷史上最重要也最賺錢的疫苗:已在全世界接種數億劑的新冠mRNA疫苗。僅2021年一年,其全球銷量就能達到500億美元。
當然,成功的道路并非一帆風順。Malone的實驗離不開前人的工作,而在Malone實驗之后的很多年里,mRNA被認為作為藥物或疫苗都太不穩定,而且太貴。數十家研究實驗室和公司嘗試了這個想法,但都無法找到脂質與核酸的完美配比——核酸是mRNA疫苗的基本成分。
今天,mRNA疫苗使用的很多新技術都是在Malone研究時期的多年后發明出來的,包括經過化學修飾的RNA和幫助這些RNA進入細胞的不同脂滴類型。不過,自詡 “mRNA疫苗發明者”的Malone依然認為自己的貢獻被忽略了。他對《自然》表示,“歷史把我遺忘了。”
隨著各大獎項的陸續揭曉,誰對這項技術具有奠基性貢獻的爭論變得沸沸揚揚——在下個月(即將到來的10月的第一周)諾貝爾獎公布前夕顯得尤為激烈。不過,一向只頒給少數幾位科學家的權威獎項難免會漏掉mRNA醫學發展史上的諸多貢獻者。其實,mRNA疫苗的成功離不開數百位研究人員在30多年里的辛勤付出。
這也反映出科學發現是如何一步步成為改變人類生活的重大突破:幾十年看不到曙光、各種拒絕、對潛在利益的你爭我奪;當然也有源源不斷的好奇心和面對質疑初心不改的豪情。
“這是很長的一串腳印。你永遠不知道哪些東西將來會大派用場。” 美國亞利桑那州大學發育生物學家Paul Krieg說。Krieg在80年代中期也做出了自己的貢獻。
Malone的實驗想法絕非憑空而來。早在1978年,就有科學家用名為脂質體的脂質膜結構將mRNA轉運到小鼠 [3] 和人類 [4] 細胞內誘導蛋白質表達。這種脂質體能包裹并保護mRNA,之后與細胞膜融合,將這種遺傳物質送入細胞。這些實驗建立在對脂質體和mRNA的多年研究之上;脂質體和mRNA都是在60年代發現的(見下圖)。

但在當時,研究人員還沒有把mRNA當作醫療產品看待,尤其是在實驗室合成這種遺傳物質的方式還沒出現的情況下。他們其實希望用mRNA來研究基礎的分子過程。大部分研究人員只能想辦法使用來自兔子血細胞、培養的小鼠細胞或一些其他動物來源的mRNA。
事情在1984年出現了轉機。當時,Krieg和哈佛大學發育生物學家 Douglas Melton 以及分子生物學家 Tom Maniatis 和 Michael Green 領導的一個團隊合作,他們利用一種RNA合成酶(取自一種病毒)和其他工具在實驗室得到了具有生物活性的mRNA [5]——這項技術的核心沿用至今。之后,Krieg將實驗室合成的mRNA注射到青蛙卵子中,證明它和自身構建的mRNA沒兩樣 [6]。
Melton和Krieg說,他們主要把合成mRNA當作研究基因功能和活性的工具。1987年,就在Melton發現這種合成mRNA能激活或抑制蛋白產生之后,他參與創立了一家名為Oligogen的公司 [后更名為吉利德科學公司(Gilead Sciences),總部在加州福斯特城],專門研究合成RNA抑制目標基因表達的方法,尋找治病的可能。但在他的實驗室或合作者中,沒有人想到疫苗。

“眾所周知,RNA極不穩定,” Krieg說,“關于RNA的一切都要非常小心。” 這或許解釋了哈佛大學的技術研發部為何不給該團隊的RNA合成技術申報專利。于是,該團隊只能把他們的試劑讓給威斯康星州麥迪遜的一家實驗用品公司 Promega Corporation,這家公司專為研究人員提供RNA合成工具。作為回報,團隊得到了一筆不多不少的專利使用費和一箱凱歌香檳。
多年后,Malone在自己的實驗中使用了哈佛團隊合成mRNA的方法。但他添加了一種新的脂質體,這種脂質體帶一個正電荷,能增強它與mRNA帶負電的骨架的結合。這種脂質體由生物化學家 Philip Felgner 開發,他現在是加州大學歐文分校疫苗研發中心的主任。

雖然Malone成功用這種脂質體將mRNA送入了人體細胞和青蛙胚胎,但他從來沒有拿到過博士學位。1989年,Malone因為和索爾克研究所的導師、基因療法研究員 Inder Verma 不咬弦,提前結束了研究生學習,來到加州的初創公司Vical替Felgner工作。在那里,他們與威斯康星大學麥迪遜分校的合作者證明了這種脂質-mRNA復合物可以促進小鼠體內的蛋白產生 [7]。

事情從這里開始變得復雜了。Vical公司(聯合威斯康星大學)和索爾克研究所都在1989年3月開始提交專利申請。但索爾克研究所很快放棄了申請,Verma則在1990年加入了Vical公司的顧問委員會。
Malone稱他的前導師Verma和Vical公司達成了一樁幕后交易,使得相關知識產權最后歸Vical所有。Malone等人被列為發明人,但他本人不能從之后的許可協議中獲利,而他本來可以從索爾克授權的專利中獲利。Malone的結論是:“他們利用我的想法發了財。”
Verma和Felgner斷然否認了Malone的指控。“這簡直就是無稽之談。” Verma告訴《自然》,撤回專利申請是索爾克研究所技術轉移處的決定。(由于被指控性騷擾,Verma在2018年從索爾克辭職,但他至今仍否認這些指控。)
Malone在1989年8月離開了Vical公司,理由是他與Felgner在 “科學判斷上” 以及在 “對他本人的知識產權貢獻上” 存在分歧。他從醫學院畢業后接受了一年的臨床培訓,后來進入了學術界,打算繼續研究mRNA疫苗,但一直拿不到經費。(1996年,他向加州的一個州立研究機構申請研究經費,用于研究預防季節性冠狀病毒感染的mRNA疫苗,但申請失敗。)Malone只能轉而研究DNA疫苗和遞送技術。
2001年,他轉型從事商務和咨詢工作。過去幾個月里,他開始公開質疑以他早前研究為基礎的mRNA疫苗的安全性。Malone說,疫苗產生的蛋白會損害人體細胞,而且疫苗的風險超過它對兒童和年輕人的益處——這種觀點受到其他科學家和衛生專家的一再反駁。
1991年,Vical 公司與大型疫苗生產商美國默克集團(Merck)達成了一項數百萬美元的研究合作和許可協議。默克集團的科研人員用小鼠測試了這一mRNA技術,試圖發明一款流感疫苗,但后來又放棄了。“生產成本和可行性迫使我們喊停。” 前默克研究人員、如今為各大公司提供疫苗研發咨詢的 Jeffery Ulmer 說。
法國斯特拉斯堡有一家小型生物技術公司,名為Transgène,那里的研究人員也有同樣的感受。1993年,Pierre Meulien 在該公司領導的一個團隊與產業界和學術界合作,首次證明了包在脂質體中的mRNA能在小鼠體內誘導出一種特異性的抗病毒免疫應答 [8]。[另一個激動人心的進展出現在1992年,當時美國斯克里普斯研究所(Scripps Research Institute)的科學家用mRNA技術取代了大鼠體內缺少的一種蛋白,用來治療代謝疾病[9]。但獨立實驗室又花了20年的時間才取得了類似的成功。]

Transgène公司的研究人員為他們的發明申請了專利,并繼續研究mRNA疫苗。Meulien當時估計他至少需要1億歐元(約1.19億美元)來優化整個平臺,但他說自己沒打算為這個 “高風險” 的項目向他的老板要這么多錢。Meulien現在已經是 Innovative Medicines Initiative 的主管,這是一家位于布魯塞爾的公私合營企業。由于Transgène的母公司決定不再續費,這個專利便失效了。
Meulien的團隊和默克的團隊一樣,后來都去研究DNA疫苗和其他基于載體的遞送系統了。DNA疫苗平臺最終獲得了一些獸醫上的應用許可,比如用來預防養魚場出現感染。就在上個月,印度的監管當局批準了全球首個供人類使用的新冠DNA疫苗(參見:印度將推出全球首個新冠DNA疫苗)。但是,DNA疫苗在人體上的進展一直很慢,個中原因迄今仍未得到完全理解。
Ulmer認為,產業界在DNA技術上的發力也帶動了RNA疫苗的進展,無論是生產和監管環節,還是序列設計和分子機制,“我們從DNA上學到的很多東西都可以直接用于RNA,” 他說,“這為RNA的成功奠定了基礎。”
從1990年代到2000年代的大部分時期里,幾乎每個想做mRNA的疫苗公司都把目光投向了別處。傳統觀點總是覺得mRNA太容易降解,生產成本太高。瑞典卡羅林斯卡醫學院病毒學家 Peter Liljeström 說:“這是一場持續的掙扎。” Liljeström在30年前開創了一種“自擴增”的RNA疫苗。
Matt Winkler說:“RNA用起來實在太難了。” Winkler于1989年在美國成立了最早專注于RNA的實驗用品公司之一Ambion。“如果你當時問我是不是可以把RNA作為疫苗打到人體內,我肯定會當著你的面大笑。”
mRNA疫苗的概念在腫瘤界倒是頗受歡迎,但研究人員主要想用它來治療疾病,而不是預防疾病。從基因治療師 David Curiel 的工作開始,許多學術人員和初創公司都在研究mRNA是否能用來對付癌癥。這里的思路是:如果mRNA能編碼癌細胞表達的蛋白,那么把mRNA注射到體內就可以訓練免疫系統去攻擊這些細胞。
目前就職于華盛頓大學醫學院的Curiel在小鼠上成功了幾次 [10]。但是當他向Ambion公司闡述其中的商業機遇時,公司告訴他:“我們看不到這個技術的任何經濟潛力。”
相比之下,另一位癌癥免疫學家取得了更多成功——1997年,全球第一家mRNA治療公司由此誕生。Eli Gilboa 的建議是從血液中獲得免疫細胞,“唆使” 它們吸收編碼腫瘤蛋白的合成mRNA,再將這些細胞注射到體內,調動免疫系統攻擊潛伏的腫瘤。
Gilboa和他在美國杜克大學醫學院的同事在小鼠中演示了以上過程 [11]。到90年代末,學術合作者已經啟動了人體試驗,Gilboa的商業衍生公司 Merix Bioscience(后更名為Argos Therapeutics,現名為CoImmune)很快開展了自己的臨床研究。整個技術看上去很有前景,但幾年后,一個已經進入后期的候選疫苗在一次大規模試驗中失敗了,這類技術現在幾乎已經很少有人關注。
雖然如此,Gilboa的工作還是產生了很重要的影響——這些工作讓CureVac和BioNTech的創始人決定投身mRNA的研究——這兩家德國公司現在已是全球領先的mRNA企業。CureVac的 Ingmar Hoerr 和BioNTech的U?ur ?ahin告訴《自然》,在了解到Gilboa的工作后,他們也想做此嘗試,但是是通過把mRNA直接注射到體內的方式。

“出現了雪球效應。” 目前在邁阿密大學米勒醫學院任職的Gilboa說。
Hoerr是第一個取得成功的。2000年,還在德國圖賓根大學的他報道了直接注射也許能誘導小鼠體內的免疫應答 [12]。他在那年創立了CureVac(也位于圖賓根),但感興趣的研究人員或投資人很少。Hoerr在一場學術會議上報告了一些早期小鼠數據,他說,“當時第一排的一位諾貝爾獎得主站起來說,‘你這些都是胡說八道,全是胡扯’。”(Hoerr拒絕透露這位諾貝爾獎得主是誰。)
但慢慢地,資金開始源源不斷地涌入,不到幾年就開始了人體實驗。該公司當時的首席科學官 Steve Pascolo 成了第一個實驗對象:他給自己注射 [13] 了mRNA,現在腿部還有一個火柴頭大小的白色傷疤,這是當時皮膚科醫生為了做多點活檢留下的。之后沒多久,公司就啟動了使用皮膚癌患者的腫瘤特異性mRNA的正規試驗。
?ahin和他的免疫學家妻子 Özlem Türeci 也是在90年代末開始研究mRNA的,但成立公司的時間要比Hoerr晚。他們倆人在德國美因茨約翰內斯古滕貝格大學研究這項技術很多年,期間專利、論文、經費全部到位,并在2007年向一位億萬富翁投資人提交了一份商業計劃書。?ahin 說:“如果能成功,將具有開拓意義。” 后來,他拿到了1.5億歐元的創業資金。

2021同年,剛剛成立的mRNA公司RNARx得到了美國政府向小企業發放的一筆相對微薄的款項:97396美元。公司的兩位創始人——生物化學家 Katalin Karikó 和免疫學家 Drew Weissman 當時都供職于美國賓夕法尼亞大學(簡稱賓大),他們做出了現在一些人認為非常關鍵的發現:改變mRNA的部分密碼子能幫助合成mRNA躲過細胞的固有免疫防御。
Karikó在整個90年代都在實驗室埋頭苦干,她的目標是讓mRNA成為一個藥物平臺,但資助機構一再拒絕了她的經費申請。1995年,在經歷多次挫敗后,賓大要求她選擇辭職或降職減薪。她最終選擇了留下,繼續追求她的目標,改進Malone的實驗方法 [14],誘導細胞產生具有治療相關性的較大復雜蛋白 [15]。

到了1997年,她開始與Weissman合作,Weissman此時剛在賓大成立了自己的實驗室。兩人計劃一起開發針對HIV/AIDS的mRNA疫苗。不過,Karikó的mRNA在注射到小鼠體內時產生了很大的炎癥反應。
她和Weissman很快找到了原因:這種合成mRNA激活了 [16] 一連串名為Toll樣受體的免疫傳感器,這些受體能在第一時間對來自病原體的危險信號作出響應。2005年,兩人發表論文指出,重新編排mRNA的一個核苷酸——尿苷——的化學鍵 ,就能創造出一種名為假尿苷的類似物,這種方法似乎能防止機體將合成mRNA視為敵人 [17]。

那個時候,很少有科學家看到修飾核苷酸的治療價值,但科學界很快就意識到了它們的潛力。2010年9月,波士頓兒童醫院干細胞生物學家 Derrick Rossi 領導一個團隊描述了如何用修飾的RNA改造皮膚細胞,先變成胚胎樣干細胞,再變成收縮的肌肉組織 [18]。研究結果引起了轟動,Rossi入選了《時代周刊》(Time)2010年 “年度重要人物” 并在坎布里奇市聯合創立了Moderna公司。
Moderna公司嘗試獲得賓大在2006年申請的Karikó和Weissman的修飾mRNA專利的許可,但晚了一步。在與RNARx達成許可協議未果后,賓大已于2010年2月向麥迪遜的一家小型實驗試劑供應商授予了獨家專利。如今名為Cellscript的這家供應商當時在協議中支付了30萬美元,現在能從Moderna和BioNTech的轉授許可費中獲得數億美元。Moderna和BioNTech是最先推出新冠mRNA疫苗的兩家公司,它們的產品都含有修飾的mRNA。
與此同時,RNARx用光了另一筆總額80萬美元的小企業資助款項,并在2013年停止經營,在這前后Karikó也加入了BioNTech(同時保留了她在賓大的兼職)。
Karikó和Weissman的發現對mRNA疫苗的成功是否關鍵,研究人員對此爭論不休。Moderna一直在使用修飾的mRNA,其公司名本身就是這兩個詞的組合。其他一些公司則不然。
馬薩諸塞州制藥公司Shire的人類遺傳學療法部研究人員給出的理由是,只要添加正確的 “帽” 結構并清除所有雜質,未修飾的mRNA也能成為一種效果類似的產品。“歸根結底還是要看RNA的質量。” Michael Heartlein 說。Heartlein在Shire負責領導科研工作,日后在 Translate Bio 繼續推進這項技術——Shire后來把它的mRNA產品線出售給了 Translate Bio。(Shire現在屬于日本的武田制藥。)
雖然Translate公司的一些人體數據顯示,其mRNA不會誘導危險的免疫應答,但它的平臺依然需要接受臨床驗證:它的候選新冠疫苗仍處于人體試驗初期。但法國制藥巨頭賽諾菲(Sanofi)很看好該技術的前景:2021年8月,賽諾菲宣布計劃以32億美元收購Translate。(Heartlein去年另起爐灶,在馬薩諸塞州創建了一家名為Maritime Therapeutics的公司。)
與此同時,CureVac公司也為緩解免疫應答提出了自己的策略,該策略需要改變mRNA的基因序列,將其疫苗中的尿苷減至最少。二十年的辛苦耕耘似乎終于有了收獲,該公司的狂犬病 [19] 和COVID-19 [20] 實驗性疫苗都在早期試驗中表現不俗。但在6月,后期的試驗數據顯示,CureVac的候選新冠疫苗在保護效力上不如Moderna或BioNTech的疫苗。
看到這些結果,一些mRNA專家現在相信,假尿苷是這項技術中不可或缺的元素,他們說,Karikó和Weissman的發現是值得認可和嘉獎的主要貢獻之一。“真正的獲獎者應該是修飾的RNA。” 專注于mRNA療法的合成生物學公司 Strand Therapeutics 的聯合創始人、首席執行官 Jake Becraft 說。
但也不是人人都這么肯定。“可能影響mRNA疫苗安全性和效力的因素有很多,mRNA的化學修飾只是其中之一。” 蘇州艾博生物科技有限公司首席執行官英博說。這家中國公司的新冠mRNA疫苗已進入臨床后期。(產品名為ARCoV,使用的是未修飾的mRNA。)
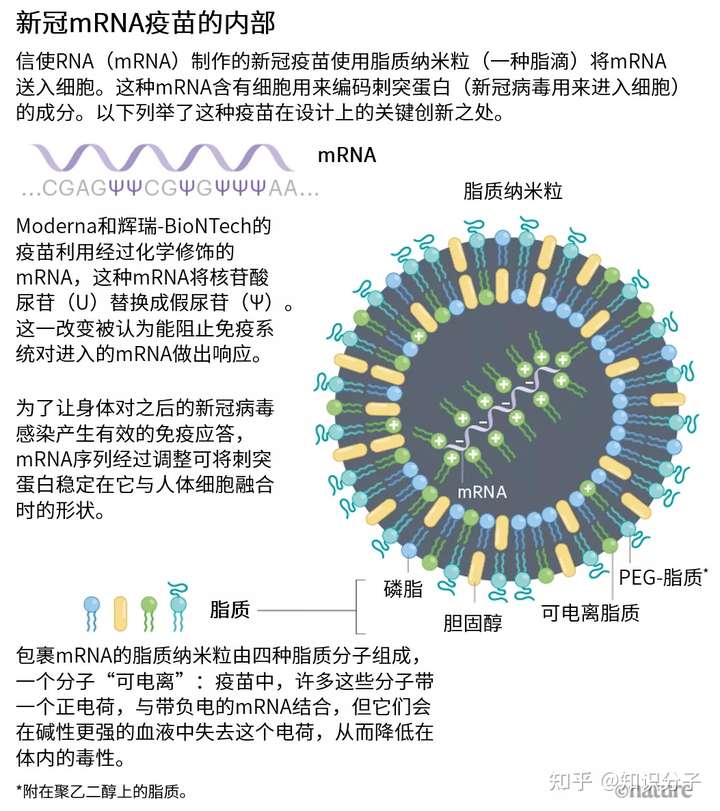
說到關鍵技術,許多專家還提到了對mRNA疫苗至關重要的另一項創新成果——這次和mRNA沒有任何關系。它就是脂質納米粒(LNP),這種微小脂滴能保護mRNA并將其送入細胞。
這項技術來自 Pieter Cullis 的實驗室和他創立或管理的多家公司。Cullis是加拿大不列顛哥倫比亞大學的生物化學家。90年代末起,他的實驗室和公司便首創將LNP用于遞送能讓基因失去活性的核酸鏈。其中一種藥物叫patisiran,現已被批準用于治療一種罕見遺傳病。

之后,基因沉默療法逐漸在臨床試驗中顯示出效果,2012年,Cullis的兩家公司開始轉型,探索LNP遞送系統在基于mRNA的藥物中的應用前景。比如溫哥華的 Acuitas Therapeutics 公司在首席執行官Thomas Madden的領導下與Weissman在賓大的團隊以及多家mRNA公司合作,共同測試mRNA-LNP的不同配比。其中一個配比已經被BioNTech和CureVac的新冠疫苗所使用。Moderna的LNP復合物也與此相差無幾。
這種納米粒含有四種脂質分子:三個分子決定結構和穩定性;第四個名為可電離脂質的分子是LNP有效的關鍵。這種物質在實驗條件下帶正電,與Felgner開發的、Malone在80年代末測試的脂質體具有類似優勢。但Cullis和商業伙伴開發的可電離脂質能在生理條件下(如在血液中)變成中性,這樣能減少對人體的毒性。
此外,混合四種脂質能讓產品的保質期更長,在體內的穩定性更好,在Cullis管理的多家公司擔任前高管的 Ian MacLachlan 說,“我們現在的藥理學是建立在所有這一切的基礎之上的。”

到了2000年代中期,研究人員想出了一種混合和生產這些納米粒的新方法,需要用到名為T-connector的裝置將脂肪(溶解在酒精中)與核酸(溶解在酸緩沖液中)結合。當兩種溶液混合時,這些成分會自發形成緊密的LNP [21]。這種方法已被證明比生產基于mRNA的藥物的其他方式更可靠。
一旦將所有碎片拼接起來,“就像是天吶,我們終于有一個可以規模化的生產流程了。” 目前在圣迭戈 Replicate Bioscience 公司擔任首席發展官的 Andrew Geall 說。2012年,Geall帶領首支團隊在諾華(Novartis)美國分部成功結合了LNP與RNA疫苗 [22]。所有mRNA公司現在都在用類似這種LNP遞送平臺和生產系統,但相關專利的歸屬權仍深陷法律糾紛。比如Moderna就與Cullis的一家公司——溫哥華的 Arbutus Biopharma ——對簿公堂:Moderna新冠疫苗使用的LNP技術到底是誰的專利?
到了2000年代末,多家大型藥企都開始向mRNA進軍。2008年,諾華和Shire都成立了mRNA研發部門——前者(由Geall領導)關注疫苗,后者(由Heartlein領導)關注藥物。BioNTech便在那年成立,其他初創公司也紛紛入局,這是因為美國國防部高級研究計劃局(DARPA)在2012年決定資助產業界研究RNA疫苗和藥物。Moderna便是在此基礎上壯大的公司之一——2015年已經籌資超過10億美元,其目標是利用mRNA誘導體內細胞產生自己的藥物,治療因蛋白缺失或失效導致的疾病。當這個計劃落空時,Moderna在其首席執行官 Stéphane Bancel 的領導下只能選擇一個更小的目標:做疫苗。

一開始,許多投資者和觀望者都非常失望,因為疫苗平臺的顛覆性和盈利性看起來都要遜色不少。截至2020年初,Moderna共有9種針對傳染病的候選mRNA疫苗進入了人體測試,但沒有一個大獲全勝。只有一個候選疫苗進入了更大規模的試驗。
面對突如其來的COVID-19,Moderna火速行動,在新冠病毒基因組序列公開后的幾天內就做好了一個原型疫苗。Moderna后來與美國國家過敏和傳染病研究所(NIAID)合作開展小鼠研究和人體試驗,這一切只用了不到10周。
BioNTech這邊也是全員出動。2020年3月,BioNTech與紐約制藥公司輝瑞(Pfizer)合作,在不到8個月的時間里破紀錄地走完了從首次人體試驗到緊急使用批準的流程。
這兩款獲得授權的疫苗都使用修飾的mRNA加入LNP,而且所含序列編碼的新冠病毒刺突蛋白的形狀更易誘導保護性免疫。許多專家表示,由NIAID疫苗學家 Barney Graham、得克薩斯大學奧斯汀分校結構生物學家Jason McLellan,以及斯克里普斯研究所的Andrew Ward設計的這種對蛋白質形狀的調整也是一個可以拿獎的成就,雖然這只針對新冠病毒疫苗,不適合所有mRNA疫苗。
圍繞mRNA貢獻的爭論,一些爭議涉及誰才擁有最賺錢的專利。但是,許多奠基性的知識產權都要追溯到Felgner、Malone和他們在Vical公司的同事在1989年(以及Liljeström在1990年)提出的觀點。這些產權從授權日起只有17年的有效期,所以現在已經不再受到專利權限制。
即使是Karikó和Weissman的專利也將在5年后過期,該專利在2006年申請,后來授權給了Cellscript公司。產業界知情人士表示,這意味著在脂質納米粒中遞送mRNA的寬泛概念很快也將難以申請專利了,但各家公司可以合理地對特定的mRNA序列申請專利,比如某種刺突蛋白的形式,或是專有的脂質配比。
各個公司已經在行動了。Moderna作為mRNA疫苗領域的主要入局者,其在流感、巨細胞病毒和一系列其他傳染病上的實驗性疫苗已經開展了臨床試驗,它在去年獲得了兩個專利,范圍涵蓋廣泛使用mRNA產生分泌蛋白(參見:RNA疫苗如何在新冠疫情中彎道超車?)。但有多位產業界知情人士告訴《自然》,他們認為這兩個專利可能會出現糾紛。
“我們感覺可申請的專利不多了。” 加拿大mRNA疫苗公司 Providence Therapeutics 的首席科學官 Eric Marcusson 說。
至于誰能拿諾貝爾獎,呼聲最高的是Karikó和Weissman。這兩位已經拿了很多獎,包括科學突破獎(Breakthrough Prizes,獎金300萬美元,科學界獎金最高的獎項)和西班牙久負盛名的阿斯圖里亞斯女親王獎(Princess of Asturias Award)技術與科學研究獎。同時獲得阿斯圖里亞斯獎的還有Felgner、?ahin、Türeci、Rossi,以及英國牛津大學和藥企阿斯利康(AstraZeneca)新冠疫苗背后的疫苗學家 Sarah Gilbert,這款疫苗沒有使用mRNA,而使用一種病毒載體。(Cullis最近一次獲獎是國際緩釋協會頒發的一個獎金5000美元的創始人獎,這是一個由研究緩釋藥物的科學家組成的專業組織。)
還有人認為,除了獎勵Karikó的研究發現,還應獎勵她對整個mRNA研究領域的貢獻。“她不僅是一位非常出色的科學家,還是領域內一股強大的力量。” 不列顛哥倫比亞大學的RNA生物工程師Anna Blakney說。為表彰Karikó的貢獻,Blakney兩年前請她在一場大型會議上演講,當時Blakney還是一名初級博士后研究員(在Blakney聯合創立英國疫苗公司VaxEquity之前,該公司主要關注自擴增RNA技術)。Karikó自己 “在整個職業生涯中備受忽視,卻不忘積極提攜他人”。
雖然mRNA發展史上的有些人認為自己應該得到更多的認可,包括Malone,但其他人卻更愿意分享這份榮譽。“你真的不能邀功,” Cullis說,以他的脂質遞送系統為例,“可能有幾百人甚至幾千人一起在做這些LNP系統,以便它能迎來自己的高光時刻。”
“所有人都在添磚加瓦,包括我。” Karikó說。
回顧過去,許多參與者都表示很高興mRNA疫苗能給人類帶來改變,以及自己有幸做出了有價值的貢獻。“見證這一切令我無比激動,” Felgner說,“我們那時堅信會發生的所有事現在都發生了。”
原文以The tangled history of mRNA vaccines 為標題發表在2021年9月14日《自然》的新聞特寫版塊上,《知識分子》獲權轉載。
參考資料
1. Malone, R. W., Felgner, P. L. & Verma, I. M. Proc. Natl Acad. Sci. USA 86, 6077–6081 (1989).
2. Malone, R. W. Focus 11, 61–66 (1989).
3. Dimitriadis, G. J. Nature 274, 923–924 (1978).
4. Ostro, M. J., Giacomoni, D., Lavelle, D., Paxton, W. & Dray, S. Nature 274, 921–923 (1978).
5. Melton, D. A. et al. Nucleic Acids Res. 12, 7035–7056 (1984).
6. Krieg, P. A. & Melton, D. A. Nucleic Acids Res. 12, 7057–7070 (1984).
7. Wolff, J. A. et al. Science 247, 1465–1468 (1990).
8. Martinon, F. et al. Eur. J. Immunol. 23, 1719–1722 (1993).
9. Jirikowski, G. F., Sanna, P. P., Maciejewski-Lenoir, D. & Bloom, F. E. Science 255, 996–998 (1992).
10. Conry, R. M. et al. Cancer Res. 55, 1397–1400 (1995).
11. Boczkowski, D., Nair, S. K., Snyder, D. & Gilboa, E. J. Exp. Med. 184, 465–472 (1996).
12. Hoerr, I., Obst, R., Rammensee, H. G. & Jung, G. Eur. J. Immunol. 30, 1–7 (2000).
13. Probst, J. et al. Gene Ther. 14, 1175–1180 (2007).
14. Karikó, K., Kuo, A., Barnathan, E. S. & Langer, D. J. Biochim. Biophys. Acta 1369, 320–334 (1998).
15. Karikó, K., Kuo, A. & Barnathan, E. Gene Ther. 6, 1092–1100 (1999).
16. Karikó, K., Ni, H., Capodici, J., Lamphier, M. & Weissman, D. J. Biol. Chem. 279, 12542–12550 (2004).
17. Karikó, K., Buckstein, M., Ni, H. & Weissman, D. Immunity 23, 165–175 (2005).
18. Warren, L. et al. Cell Stem Cell 7, 618–630 (2010).
19. Aldrich, C. et al. Vaccine 39, 1310–1318 (2021).
20. Kremsner, P. G. et al. Wien. Klin. Wochenschr. https://doi.org/10.1007/s00508-021-01922-y (2021).
21. Jeffs, L. B. et al. Pharm. Res. 22, 362–372 (2005).
22. Geall, A. J. et al. Proc. Natl Acad. Sci. USA 109, 14604–14609 (2012)