目前SARS-CoV-2臨床試驗用脂質納米顆粒的開發
mRNA最早的轉染試劑是季銨化陽離子DOTAP結合可電離和融合的DOPE,采用DNA轉染[85],用于在眾多細胞類型中轉染mRNA[86]。盡管在體外有效,但永久性陽離子季銨基團使這些大尺寸的脂復合物從循環和其通常靶器官肺中迅速清除,并表現出毒性。今天LNP的先驅是穩定的質粒-脂質顆粒(SPLP),它是由融合基因電離的DOPE與季銨化的陽離子脂質DODAC結合形成的,DODAC靜電結合并包裹質粒DNA,然后用親水性PEG包被,使其在水介質中穩定,并在體內給藥時限制蛋白質和細胞相互作用[87]。DOPE在細胞攝取后可在內涵體中質子化,由于呈錐形,因此可與內涵體磷脂形成內體溶解離子對,以促進內涵體釋放,這是成功遞送的關鍵事件[17]。然后進一步將SPLP開發為含有siRNA的穩定核酸脂質顆粒(SNALP),包括四種脂質:離子化而不是季銨化陽離子脂質、飽和雙層形成季銨化兩性離子脂質、DSPC、膽固醇和PEG脂質[88]。除了與核酸靜電結合外,SNALPs中的可電離脂質發揮了融合脂質的作用,并在內涵體中質子化,與內涵體磷脂形成膜不穩定離子對。目前已知DSPC有助于在PEG表面下形成穩定的雙層[89]。膽固醇發揮多種作用,包括填補顆粒間隙、限制LNP–蛋白質相互作用和可能促進膜融合[90]。可電離脂質在生理pH下呈中性,從而消除循環中的任何陽離子電荷,但在pH~6.5的內體中質子化,促進內體釋放,發揮核心作用。
2018年臨床批準的首個siRNA產品的開發主要集中在優化可電離脂質,其次是PEG脂質和LNP中使用的四種脂質的比例,以及LNP組裝和生產程序。根據分子形狀假設[12,91],發現C18尾中不飽和鍵的最佳數量是通過醚連接到二甲胺頭基的二亞油酸尾[88]。然而,在亞油酸尾部引入單個連接體,其具有從二甲胺頭基到連接體的優化碳數,導致LNP中可電離脂質DLin-MC3-DMA的pKa接近6.4[92,93]。優化的最后一步是將MC3/DSPC/膽固醇/PEG–脂質的這些脂質摩爾比調節至50/10/38.5/1.5。總體從DLin-DMA到DLin-MC3-DMA的這一優化過程需要在數千種制劑中篩選超過300種可電離的脂質,并導致效價增加200倍和有效劑量相應減少,以實現對靶基因> 80%的持久抑制和允許治療窗,2018年Onpattro™獲得臨床批準[94,95]。這種為siRNA開發的MC3配方是隨后開發LNPs的基礎,如下所述(圖1),在被批準用于SARS-CoV-2 mRNA疫苗的遞送后,LNPs現在正被緊急使用。
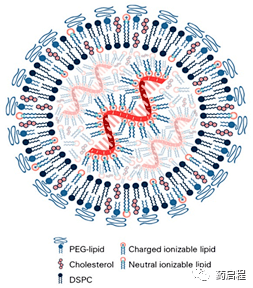
圖1 mRNA脂質納米顆粒結構。最近使用冷凍電子顯微鏡[96]、小角中子散射和小角X射線散射[89]進行的研究表明,mRNA脂質納米顆粒包括低拷貝數的mRNA(1-10),并且mRNA與占據LNP中心核心的可電離脂質結合。聚乙二醇(PEG)脂質形成脂質納米顆粒(LNP)的表面,同時形成雙層的DSPC。帶電荷和不帶電荷的膽固醇和可電離脂質可分布在整個LNP中。其他輸送系統的結構示意圖在最近的綜述中提供[14]。
Moderna使用上述Onpattro制劑中的MC3進行了幾項臨床前[97,98,99]和臨床研究[97,100],以遞送核苷修飾的mRNA編碼免疫原。在這些比較新的一類可電離脂質與MC3的研究中,MC3后來被確定為可電離脂質[42,101]。這個新類別包括Lipid H[42],它是Moderna的SARS-CoV-2產品mRNA-1273中的可電離脂質SM-102[41](表2)。
使用針對寨卡病毒的核苷修飾的mRNA編碼免疫原,MC3 LNP能夠保護缺乏I型和II型干擾素(IFN)信號的免疫功能低下小鼠免受10µg劑量1次或2µg劑量初免-加強免疫設計的致死攻擊[99]。在預先給予抗ifnar1阻斷抗體以建立致死模型的免疫功能正常小鼠中也獲得了相似的結果。在一系列遞送核苷修飾的mRNA編碼血凝素(HA)免疫原的流感研究中,皮內遞送的MC3 LNP能夠完全保護小鼠免受低至0.4µg單次給藥的致死性攻擊,盡管即使單次給予高達10µg劑量,攻毒后也會出現體重減輕[97]。雪貂單次給予50µg或100µg劑量產生了較高的HAI(血凝抑制試驗)滴度,非人靈長類動物單次給予200或400µg劑量也產生了較高的HAI滴度。在接受100µg劑量的少數(23)人類受試者中,在研究開始時,所有受試者的HAI滴度均 > 40(who保護相關性),比基線高4倍以上。在一項更大規模的1期試驗中,使用相同的MC3 LNPs遞送兩種不同的核苷修飾的mRNA編碼的HA免疫原,肌肉注射100µg的H10N8免疫原導致23名受試者中100%的HAI滴度 > 40[100]。盡管未發生危及生命的不良事件,但這23例受試者中有3例發生了重度3級不良事件。3例受試者中的2例發生3級不良事件(符合研究暫停規則)后,停止計劃的400µg給藥。在較低劑量下,不良事件的頻率和嚴重程度降低,但幾乎每例受試者均發生至少1起不良事件。這些研究很有前景,但也強調了在不會引起問題數量的不良事件的劑量下獲得保護性免疫的治療窗相對較窄。這讓人想起MC3前體DLin-DMA的治療窗窄,需要提高效力才能降低劑量,仍然實現有效的基因敲低。
表2脂質納米顆粒中使用的可電離脂質。脂質納米顆粒中使用的可電離脂質的一個關鍵特征是,通過TNS染料結合試驗測定,LNP中可電離脂質的pKa應在6-7范圍內。理論上計算的大多數可電離基團的pKa在8-9.5范圍內,如下所示在氮原子上,使用商業軟件理論上估計水介質中的這些值。pKa從理論值下降2-3個點至TNS值是由于脂相中質子的溶劑化能量更高,導致脂相中的pH值比水相高2-3個點,在TNS測定期間測量pH值[102]。
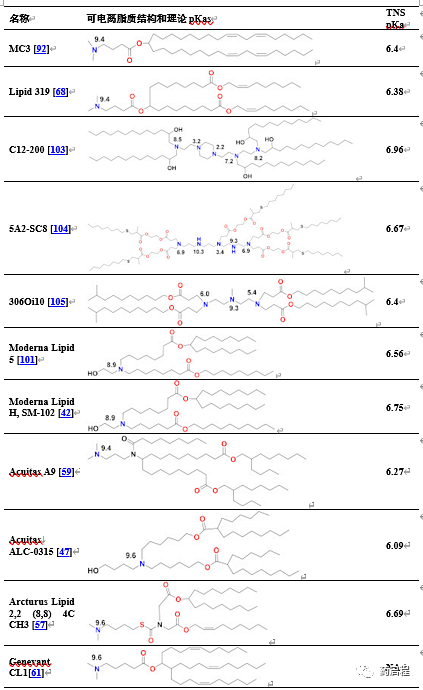
由于siRNA產品需要重復給藥治療慢性疾病,人們擔心MC3中二亞油酸烷基尾的緩慢降解會導致重復給藥的蓄積和潛在毒性。MC3的生物可降解版本脂質319(表2)是通過用在體內易于被酯酶降解的伯酯取代每個烷基鏈中兩個雙鍵中的一個而產生的[68]。觀察到脂質319在肝臟中的半衰期小于1小時,而其在肝臟中保持與MC3相似的基因沉默效率。在體內證實了降解產物,以及其分泌和脂質319的無毒性質。在SARS-CoV-2的臨床前和臨床研究中引用了脂質319的研究,作為BioNTech[49]和CureVac[53,69]產品中使用的Acuitas LNP類別,盡管在倫敦帝國理工學院試驗[60]中Acuitas LNP遞送的自擴增RNA被引用為包含在最近的專利申請中[59],這里由Acuitas的Lipid A9代表(表2)。最近,BioNTech批準的BNT162b2中Acuitas可電離脂質的同一性被披露為ALC-0315[40](表2)。這些LNPs的一個重要方面是,它們是通過篩選IV給藥后肝臟中的mRNA表達而開發的,可能還沒有完全優化用于基于mRNA的疫苗的肌內給藥。
Moderna最近開發了一類新的可電離脂質來替代MC3,主要是由于上述與MC3降解緩慢相關的問題,但也努力通過實現比二亞油酸MC3烷基尾更大的分支來提高其效力[42,101]。這類新脂質具有乙醇胺可電離頭基,與含有一級降解酯(如Maier 2013)的單個飽和尾連接,并與第二個飽和尾連接,后者使用降解性較低的二級酯在7個碳原子后分支成兩個飽和C8尾,如脂質5[101](表2)。優化用于肝臟IV給藥,發現相似的脂質H[42]或SM-102是疫苗肌內(IM)給藥的最佳選擇。分支增加是Acuitas追求的共同特征,因為Lipid A9共有5個分支鏈[59](表2),而Moderna LNPs有3個分支鏈。分支增加被認為可產生具有更多錐形結構的可電離脂質,因此,當與內體中的陰離子磷脂配對時,將發生更大的膜破壞能力,遵循幾十年前概述的分子形狀假設[12,91]。當IV給藥時,24h時在肝臟中檢測不到脂質5,而MC3以其初始劑量的71%存在于肝臟中,驗證Lipid 5的降解性。IV給藥后,Lipid 5在小鼠中熒光素酶表達的效力是MC3的3倍,在非人靈長類動物中hEPO的效力是MC3的5倍。這些效力的增加與胞內體釋放增加一致,可能是由胞內體釋放增加引起的,對于Lipid 5,細胞中高達15%的mRNA從胞內體釋放,而MC3為2.5%,后者與之前使用siRNA測定的MC3的結果相似[106]。然而,在這些內體釋放實驗中,MC3的細胞攝取是Lipid 5的4倍,因此這兩種LNPs在細胞質中釋放的mRNA的絕對量相似。在疫苗的肌內給藥中檢查了相同的可電離脂質庫,同樣發現可降解,并且由于伯酯而迅速消除,并且對于流感核苷修飾的mRNA%__,與MC3相比,在蛋白表達或免疫原性方面效價通常增加3-6倍。小鼠中%編碼的免疫原,盡管非人靈長類動物中的免疫原性與5µg初免-加強免疫劑量下的MC3相同[42]。脂質H或SM-102(表2)被確定為最佳候選藥物,在結構上僅與通過伯酯的二碳置換確定為IV給藥最佳的脂質5不同。脂質5 LNP的pKa為6.56,而脂質H LNP的pKa為6.68,表明IM與IV給藥相比,pKa略微增加可能有益,盡管該差異在試驗的變異性范圍內。大鼠肌肉注射部位的組織學檢查表明,與MC3相比,Lipid HLNPs吸引的中性粒細胞和巨噬細胞富集的炎性浸潤較少,這可能會降低人體試驗中注射部位的反應原性[42]。
目前SARS-CoV-2臨床試驗中的mRNA脂質納米顆粒
5.1.BioNTech/Pfizer
Acuitas ALC-0315(表2)結合DSPC、膽固醇和PEG脂質是BioNTech SARS-COV-2試驗中的遞送系統[40]。CureVac和倫敦帝國理工學院也可能使用ALC-0315,或可能使用A9(表2)。
BioNTech開始用4種mRNA編碼的免疫原開發其SARS-CoV-2疫苗,其中2種是核苷修飾的,1種是未修飾的,1種是自我擴增的。有兩種核苷修飾的mRNA的報道:BNT162b1是編碼刺突蛋白受體結合域的短的~1kb序列,通過foldon三聚體結構域修飾,通過多價顯示增加免疫原性。較長的4.3kb BNT162b2編碼一個二脯氨酸穩定的全長膜結合刺突蛋白。BNT162b2最近獲得了歐盟和美國的緊急批準。
在一項臨床前研究中,小鼠單次給予0.2、1和5µg BNT162b2后,可檢測到結合抗體和中和滴度。從最低劑量到最高劑量增加一個數量級,在Th2細胞因子水平非常低的CD4 + 和CD8 + 脾細胞中引起強烈的抗原特異性Th1 IFNγ和IL-2應答[49]。引流淋巴結中還含有大量生發中心B細胞以及CD4 + 和CD8 + 濾泡輔助性T(Tfh)細胞計數升高,這些細胞先前被確定為mRNA LNP疫苗中LNP單獨誘導的一部分[33]。在非人靈長類動物中,30µg或100µg的初免-加強免疫劑量引起的結合抗體和中和滴度是人恢復期試驗組的10倍以上,并且產生強烈的Th1偏倚T細胞應答,該應答被認為對預防疫苗相關的增強呼吸道疾病很重要[107]。在有限數量(6)的攻毒恒河猴中,兩次100µg劑量在支氣管肺泡灌洗和鼻拭子中檢測不到病毒滴度。
較小mRNA編碼免疫原BNT162b1的1期臨床試驗計劃在第1天和第21天給予10、30和100µg劑量。中等劑量30µg誘導的抗體結合和中和滴度分別是人恢復期組的30倍和3倍。由于首次給藥后存在重度注射部位疼痛,因此未給予100µg劑量進行加強劑量。30µg加強劑量組100%的受試者報告了注射部位疼痛,但嚴重程度為輕度或中度。以30µg劑量第二次接種疫苗后,幾乎所有受試者均發生輕度或中度全身不良事件發熱、寒戰或疲乏。該試驗還證明了外周血單核細胞對Th1偏倚T細胞的強烈應答[50]。
一項2期試驗在年輕(18-55歲)和年長(65-85歲)受試者組中比較了BNT162b1和BNT162b2[51]。老年受試者的結合和中和抗體滴度略低,但仍超過恢復期組。與年輕受試者相比,老年受試者的不良反應嚴重程度也降低。與BNT162b1相比,在BNT162b2中發現全身不良事件(發熱、寒戰、疲乏)的頻率顯著降低約兩倍。正是BNT162b2耐受性的增加推動了其選擇進入3期試驗,最近宣布了94%的有效性,因為在安慰劑組中發生了162例COVID-19病例,而在接受兩次30µg BNT162b2給藥的疫苗接種組中僅發現了8例病例[3]
5.2. Moderna
在Moderna的研究中,核苷修飾的mRNA編碼免疫原是一種跨膜錨定的二脯氨酸穩定的融合前刺突,具有天然的furin裂解位點,并在原型MC3 LNP基礎上的LNP中遞送,只是用Lipid H(SM-102)替代MC3[41,42]。該mRNA LNP(mRNA-1273)在第1天和第21天以1µg劑量注射時在幾種小鼠種屬中誘導中和抗體,但在0.1µg劑量時未誘導中和抗體[44]。T細胞應答似乎是平衡的Th1/Th2應答,在小鼠適應的病毒攻毒模型中,小鼠肺和鼻甲中的病毒滴度在2次劑量1µg給藥后降低至基線,但在0.1µg給藥后未降低。在恒河猴中,2劑100µg劑量在外周血中產生高結合和中和滴度以及Th1偏倚反應,也涉及強烈的Tfh反應[45]。兩個10µg劑量組的滴度和T細胞應答顯著降低。同樣,100µg劑量能夠將支氣管肺泡灌洗液和鼻拭子中的病毒滴度降低至基線,而10µg僅在肺部降低。
在1期研究中,每組15例患者接受2劑25、100或250µg,間隔4周,結合和中和滴度比100µg劑量的恢復期高約10倍,約相當于25µg的恢復期[46]。100µg和250µg劑量組所有受試者均報告征集性不良事件,250µg組14例受試者中的3例報告重度不良事件并停藥。在隨后的老年患者(56-71歲和71歲以上)1期研究中,發現25µg和100µg劑量產生的結合抗體滴度高于恢復期血漿,而100µg劑量的中和滴度相當,但低于25µg劑量的恢復期[43]。大多數患者(約80%)在第二次接種疫苗后仍發生不良事件,即使是在老年組。外周血分析顯示CD4 T細胞應答存在Th1偏倚。與25µg劑量相比,100µg劑量的中和滴度更高,因此選擇該劑量用于3期試驗,中期結果顯示90例COVID-19病例在安慰劑組與5例在疫苗接種組具有94.5%的有效性[2]。一個獨立的委員會對Moderna的3期試驗進行了中期分析,發現嚴重不良事件包括9.7%的參與者出現疲勞,8.9%出現肌肉疼痛,5.2%出現關節痛,4.5%出現頭痛,而在輝瑞/BioNTech的3期試驗中,頻率較低的是疲勞為3.8%,頭痛為2%[108]。
5.3. CureVac
The CureVac mRNA LNP(CVnCoV)是一種非化學修飾的序列工程mRNA,編碼在Acuitas LNP中遞送的二脯氨酸穩定的全長S蛋白,可能使用可電離脂質ALC-0315。在小鼠中使用2µg劑量時,檢查了兩次給藥之間的周數,范圍為1-4周,發現Balb/c小鼠中較長的間隔產生了較高的滴度和T細胞應答以及平衡的Th1/Th2應答[53]。需要第二次給藥以產生中和抗體,0.25µg的兩次給藥不足以產生中和抗體。在敘利亞金黃地鼠中,兩次10µg劑量(而非2µg)能夠將肺(而非鼻甲)中的病毒滴度降低至基線。
在檢查2-12µg劑量的1期臨床試驗中,僅在最高12µg劑量下發現達到恢復期血清水平的中和滴度,導致正在進行的2期試驗納入更高劑量16和20µg[52]。接受12µg劑量的所有患者在每次給藥后均發生全身不良事件,大多數為中度和重度,而 > 80%的患者在輕度和中度水平發生局部注射部位疼痛。
5.4. TranslateBio
Translate Bio使用非修飾的mRNA編碼雙突變形式的二脯氨酸穩定的刺突蛋白,并通過被引用為基于可電離脂質C12-200[109]的LNP進行遞送,其可能是最近從ICE-[110]或基于半胱氨酸的[55]可電離脂質家族合成的候選物。在Balb/c小鼠中,0.2–10µg范圍內的兩次給藥導致結合和中和滴度遠高于恢復期水平。在非人靈長類動物中,15、45和135µg劑量產生的滴度均超過人恢復期組[56]。免疫應答也存在Th1偏倚。
5.5. Arcturus
Arcturus使用自擴增、全長、未修飾的mRNA編碼融合前SARS-CoV-2全長刺突蛋白,通過LNP進行遞送,該LNP使用可電離脂質與硫酯,通過兩個額外的酯基將含胺的頭基與脂質尾部連接。該家族中兩種可能的可電離脂質是脂質10a([111]的表4)或脂質2,2(8,8)4 C CH3([57]的第33頁)(表2)。后者有三個分支,類似于Moderna Lipid H,但有一個可降解的硫酯與頭基連接。觀察到自身擴增mRNA的特征,即IM給藥后1周以上,熒光素酶報告基因表達維持在相當恒定的水平,而常規mRNA表達迅速下降[58]。
單獨接種疫苗在C57BL/6小鼠中產生了令人驚訝地體重減輕和臨床評分增加。小鼠中僅需要2µg或10µg(而非0.2µg)單次給藥,即可在Th1偏倚應答中達到高于100的中和滴度,并具有高水平的抗原特異性T細胞應答。在K18-hACE2致死小鼠激發模型中,2µg或10µg單次給藥也具有100%保護作用,100%存活,無體重減輕,肺和腦病毒滴度降低至基線水平。Arcturus已經完成了1期臨床試驗,劑量為1-10µg,并選擇7.5µg進行3期試驗[112]。
5.6.帝國理工學院
倫敦帝國理工學院使用Acuitas LNP遞送的自擴增mRNA編碼的融合前穩定的刺突蛋白,該LNP在Lipid A9[60]代表的專利[59]中進行了描述(表2)。在Balb/c小鼠兩次注射0.01µg至10µg劑量范圍后,獲得了較高的劑量依賴性抗體和中和滴度。該應答存在強烈的Th1偏倚,與較低的0.1和0.01µg劑量相比,10和1µg劑量產生的抗原特異性脾細胞應答高3倍。這種疫苗的1期臨床試驗即將開始。
5.7.朱拉隆功大學、賓夕法尼亞大學
朱拉隆功大學與賓夕法尼亞大學合作,正在使用Genevant LNP(可能是CL1脂質)開發一種天然的加標免疫原核苷修飾的mRNA LNP[61]。他們的目標是在2021年第1季度開始1期臨床試驗,并在2021年第4季度開始將疫苗分發給泰國和7個周圍的低至中等收入國家。
5.8. Providence Therapeutics
Providence Therapeutics被授予加拿大衛生部許可進行PTX-COVID-19B mRNA LNP疫苗人體臨床試驗的通知[113]。C57BL6小鼠按照初免-加強免疫方案接受20µg劑量給藥后,對編碼受體結合域(furin裂解位點有或無突變的全長加標物)的三種mRNA候選物進行臨床前研究[114]。來自Genevant未披露脂質的臨床前數據結果(可能與表2中的CL1相似)顯示出對于全長和furin突變有效負載的穩健中和滴度,與[115]中觀察到的數據相似。1期臨床試驗計劃于2021年第一季度開始,疫苗的生產和分銷——等待監管批準——在同年進行。
5.9.儲存和分銷
大多數在實驗室中制造的RNA LNPs在4 °C下可穩定數天,但隨后表現出體積增大和生物活性逐漸喪失,如熒光素酶表達[116]。在之前的siRNA LNP制劑中,通常觀察到LNP聚集的大小隨時間增加[117]。為了穩定用于儲存和分銷的mRNA LNP疫苗,迄今為止需要冷凍形式。Moderna COVID-19疫苗需要在-25 ℃~-15 ℃保存,但在2 ℃~8 ℃之間也可穩定長達30天,在8 ℃~25 ℃之間可穩定長達12 h[118]。輝瑞/BioNTech COVID-19疫苗需要在-80 ℃至-60 ℃下儲存,然后解凍并在2 ℃至8 ℃下儲存長達5天,然后在注射前用生理鹽水稀釋[119]。
與Moderna疫苗所需的常規冷凍溫度相比,輝瑞疫苗在分銷和儲存期間所需的干冰溫度更難達到。這些溫差背后的原因并不明顯,因為兩種疫苗均含有相似的高濃度蔗糖作為冷凍保護劑。Moderna mRNA LNPs在Tris和醋酸鹽兩種緩沖液中冷凍[41],而Pfizer/BioNTech疫苗僅使用磷酸鹽緩沖液[40]。已知磷酸鹽緩沖液對冷凍不理想,因為其易于沉淀,并在冰結晶開始時引起pH值突然變化[120,121]。凍干對于mRNA LNPs一直具有挑戰性[116]。然而,Arcturus表示,他們的COVID-19 mRNA疫苗在凍干形式下是穩定的,這大概會大大簡化分布,盡管這種凍干制劑的溫度穩定性尚未披露[122]。
原文來源:Automated Manufacture of Autologous CD19 CAR-T Cells for Treatment of Non-hodgkin Lymphoma.Front.Immunol.11:1941. DOI:10.3389/fimmu.2020.01941